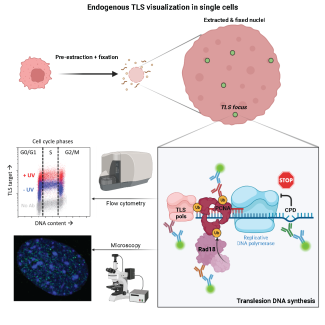
Detection of endogenous translesion DNA synthesis in single mammalian cells
Egger T, Aze A, Maiorano D
Bases moléculaires de pathologies humaines
L'équipe s'intéresse en général à la régulation de la réponse aux dommages à l'ADN (DNA Damage response ou DDR), et en particulier à sa régulation au cours du développement embryonnaire. La fonction de la DDR est de ralentir ou bloquer le cycle cellulaire si l'ADN présente des lésions (cassure des brins, intégrité des télomères, arrêt de la synthèse d'ADN) afin d’empêcher la prolifération cellulaire en présence d'ADN endommagé et de ce fait, éviter la propagation de mutations qui sont à la base de l'instabilité génomique. Une forte instabilité génomique est caractéristique de la plupart des cancers (fusions télomèriques, translocations, duplications et délétions). Aujourd'hui on pense que la majorité des tumeurs sporadiques sont dues à des mutations dans des gènes participant à la DDR, ce qui aboutit également à la prédisposition à des maladies génétiques. De ce fait, la DDR joue un rôle clé dans le maintient de la stabilité du génome et fonctionne comme un barrière à la transformation maligne.

Egger T, Aze A, Maiorano D
Lo Furno E., Busseau I., Aze A., Lorenzi C., Saghira C., Danzi M., Zuchner S., Maiorano D.
Lo Furno E, Recolin B, van der Laan S, Aze A, Maiorano D
Maiorano D, El Etri J, Franchet C, Hoffmann JS
Jihane Basbous, Antoine Aze, Laurent Chaloin, Rana Lebdy, Dana Hodroj, Cyril Ribeyre, Marion Larroque, Caitlin Shepard, Baek Kim, Alain Pruvost, Jérôme Moreaux, Domenico Maiorano, Marcel Mechali, Angelos Constantinou
Aze A, Maiorano D
Hodroj, D., Serhal, K., Maiorano, D.
Hodroj D, Recolin B, Serhal K, Martinez S, Tsanov N, Abou Merhi R, Maiorano D
Kermi, C., Lo Furno, E., Maiorano, D
Benkafadar N, Menardo J, Bourien J, Nouvian R, François F, Decaudin D, Maiorano D, Puel JL, Wang J.
Lo Furno, E., van der Laan, S., and Maiorano, D.
Kermi, C., Prieto, S., van der Laan, S., Tsanov, N., Recolin, B., Uro-Coste, E., Delisle, M-B., and Maiorano, D.
Tsanov, N., Kermi, C., Delgado, J., Serrano, L., Maiorano D.
Vanacker JM, Maiorano D.
Recolin B, van der Laan S, Tsanov N, Maiorano D.
van der Laan S, Golfetto E, Vanacker JM, Maiorano D.
Van der Laan, S., Maiorano, D.
Tsanov, N., Kermi, C., Coulombe, P., Van der Laan, S., Hodroj, D., Maiorano, D.
Van der Laan, S., Crozet, C., Tsanov, N., and Maiorano, D
Maiorano, D., Hoffmann, JS.
Bétous R., Pillaire, M-J, Pierini, L., Van der Laan, S., Recolin B., Ohl-Séguy, E., Guo, C., Niimi, N., Gruz, P., Nohmi, T. Friedberg, E., Cazaux, C., Maiorano, D* and Hoffmann J-S*. * corresponding authors
Recolin, B., Van der Laan, S., and Maiorano, D.
Recolin, B., Maiorano, D
Recolin, B., Maiorano, D.
Levy N, Oehlmann M, Delalande F, Nasheuer HP, Van Dorsselaer A, Schreiber V, De Murcia G, Ménissier-de Murcia J, Maiorano D, Bresson Anne.
Auziol C, Mechali M, Maiorano D.
Lutzmann M, Maiorano D, Mechali M.
+
Réplication et Dynamique du Génome
Maiorano D, Lutzmann M, Mechali M.
+
Réplication et Dynamique du Génome
Lutzmann, M., Maiorano, D., and Méchali, M.
+
Réplication et Dynamique du Génome
Maiorano, D., Cuvier, O., Danis, E., and Mechali, M.
+
Réplication et Dynamique du Génome
Maiorano, D., Krasinska, L., Lutzmann, M. and Mechali M.
+
Réplication et Dynamique du Génome
Françon, P. ; Lemaitre, JM., Dreyer, C. ; Maiorano, D. ; Cuvier, O. and Marcel Méchali.
+
Réplication et Dynamique du Génome
Thepaut, M., Maiorano, D., Guichou, JF., Auge, MT., Dumas, C., Méchali, M., and Padilla, A.
+
Réplication et Dynamique du Génome
Danis, E., Brodolin, K., Menut, S., Maiorano, D., Girard-Reydet, C. and Marcel Méchali.
+
Réplication et Dynamique du Génome
Maiorano, D., Rul, W., and Marcel Mechali
+
Réplication et Dynamique du Génome
Tada, S., Li, A., Maiorano, D., Méchali, M., and Blow, J.
+
Réplication et Dynamique du Génome
Maiorano, D., Moreau, J., and Méchali, M.
+
Réplication et Dynamique du Génome
Maiorano, D., Lemaître, J.M. and Méchali, M.
+
Réplication et Dynamique du Génome
Françon, P., Maiorano, D. and Méchali, M.
+
Réplication et Dynamique du Génome
Coué, M., Amariglio, F., Maiorano, D., Bocquet, S. and Méchali, M.
+
Réplication et Dynamique du Génome
Soutenue par Elena Lo Furno le 25/11/2019 sous la direction de Domenico Maiorano
Soutenue par Chames Kermi le 14/12/2016 sous la direction de Domenico Maiorano
